zoonosi

L’EFSA e l’ECDC hanno pubblicato il loro ultimo rapporto annuale sull’ andamento delle zoonosi nell’UE. Il numero di casi di campilobatteriosi e salmonellosi, rispettivamente prima e seconda tra le malattie zoonotiche più frequentemente segnalate, è rimasto inferiore rispetto a quelli degli anni pre-pandemici 2018-2019, ma contestualmente il rapporto evidenzia un aumento del numero di infezioni da virus del Nilo occidentale. Il 2022 è stato infatti l’anno con il secondo maggior numero di casi di infezioni registrati nell’UE e questo potrebbe essere legato alle condizioni climatiche favorevoli all’attività delle zanzare, il report sottolinea quindi l’importanza dell’approccio “One Health” al fine di integrare le valutazioni del rischio per l’uomo e per gli animali, in un’ottica di salute unica globale.
Focolai
Il numero di focolai veicolati da alimenti è aumentato nel 2022 del 44%, raggiungendo livelli simili a quelli degli anni pre-pandemici.
Viene registrato quindi un aumento dei decessi causati principalmente da Listeria monocytogenes, associati al consumo di una vasta gamma di alimenti, come carne, latticini, pesce e verdure. È comunque importante sottolineare che l’uso più ampio del sequenziamento dell’intero genoma degli isolati batterici può avere migliorato la sorveglianza e la capacità di individuare i focolai negli stati membri.
Fonte: Efsa
Nel Report dell’ EFSA e dell’ ECDC vengono presentati i risultati del Monitoraggio svoltosi nel 2021 in 27 paesi membri , in 9 ” non – membri ” e nel Regno Unito.
Nel 2021 la prima e la seconda zoonosi maggiormente registrate risultano essere rispettivamente la campylobatteriosi e la salmonellosi, in aumento rispetto a quanto rilevato nel 2020, ma sempre in numero inferiore rispetto agli anni antecedenti il periodo pandemico.
La Listeriosi e l’ infezione da virus West Nile sono risultate essere le cause principali del più alto tasso di ospedalizzazione causata da Zoonosi, associate anche al maggior numero di casi fatali.
La Salmonella si conferma il principale agente responsabile di focolai di origine alimentare, le fonti principalmente imputate sono state uova, ovoprodotti e ” alimenti misti”.
23 sono i focolai causati da Listeria monocytogenes, il numero più alto mai registrato, legato, come si sottolinea sul sito dell’ EFSA, anche ad un maggior ricorso da parte degli esperti scientifici, a tecniche di laboratorio specifiche che consentono una maggiore definizione dei focolai.
Il rapporto presenta poi, come di consueto, i dati relativi ad altri agenti zoonotici e zoonosi, come Mycobacterium bovis/caprae, Brucella, Trichinella, Echinococcosi, Toxoplasmosi, rabbia, febbre A, virus della Valle del Nilo e tularemia.
Fonte : EFSA
La giornata è stata istituita allo scopo di sensibilizzare l’opinione pubblica sull’importanza dell’impatto di questa malattia sull’uomo e gli animali. La rabbia è una malattia infettiva sostenuta da un virus, è una zoonosi, si trasmette all’uomo attraverso il contatto con la saliva di animali infetti.
La rabbia può essere controllata attraverso strategie di eradicazione e di prevenzione dell’infezione, con la vaccinazione degli animali e delle persone esposte al rischio.
La prevenzione più efficace al controllo della rabbia implica l’approccio One Health, che significa promuovere una collaborazione tra i settori umano, animale e ambientale.
Tutte le persone che vengono a contatto con animali sospetti di rabbia, sia in vita che morti, devono adottare delle misure di protezione idonee ed i prelievi per la diagnosi devono essere effettuati da personale autorizzato.
Per approfondimenti visita la nostra pagina “La rabbia”
Il ciclo “Focus sulla conoscenza“, si è chiuso il 15 giugno, con il webinar:
“Rapporto del 2020 sulle zoonosi nell’Unione Europea”
Nel I semestre di quest’anno il personale e i ricercatori dell’IZS Lazio e Toscana hanno presentato argomenti scientifici di attualità nelle aree della sanità e benessere animale, sicurezza alimentare, igiene degli allevamenti e delle produzioni zootecniche, metodi di laboratorio, tutte frutto delle attività di diagnostica e di ricerca svolte.
I seminari, sotto forma di webinar e aperti all’esterno dell’Istituto, hanno registrato una elevata partecipazione e interesse.
I laboratori della sezione di Arezzo dell’IZS Lazio e Toscana hanno riscontrato larve di Trichinella britovi (come da conferma del Laboratorio nazionale di Riferimento presso l’Istituto Superiore di Sanità) nel muscolo tibiale anteriore di una lupa trovata morta nel comune di Subbiano, probabilmente a seguito di trauma stradale.
Nelle regioni Toscana e Lazio vi sono state altre segnalazioni del parassita negli scorsi anni:
- marzo 2013: riscontro di larve Trichinella in una volpe ancora in provincia di Arezzo
- gennaio 2013: ventisei persone, tra cacciatori e loro familiari, sono state colpite da trichinellosi nell’Alta Val del Serchio a seguito dell’ ingestione di salsicce di cinghiale crude contaminate;
- Nella stagione venatoria 2019-2020 la sezione di Latina dell’IZS Lazio e Toscana ha identificato larve di Trichinella nelle carni di cinghiali abbattuti a caccia, poi identificate come appartenenti alla specie Trichinella britovi.
La trichinellosi
-

-
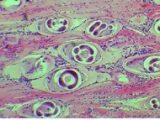
Larve Trinella nel muscolo
-
-
Larve Trichinella nel muscolo
-

-
Larva di Trichinella (foto di Tiziana Zottola)
La trichinellosi è una grave zoonosi (malattie trasmissibili dagli animali all’uomo) causata da vermi cilindrici (nematodi) appartenenti al genere Trichinella, un parassita che inizialmente si localizza a livello intestinale per poi dare origine a una nuova generazione di larve che migrano nei muscoli, dove poi si incistano.
Il parassita è in grado di infestare i mammiferi, gli uccelli e i rettili, soprattutto i carnivori e gli onnivori (maiale, volpe, cinghiale, cane, gatto, uomo).
Modalità di trasmissione
La trasmissione all’uomo avviene esclusivamente per via alimentare, attraverso il consumo di carne cruda o poco cotta contenente le larve del parassita.
In Italia, il veicolo di trasmissione è la carne suina (maiale o cinghiale), equina e più raramente di carnivori selvatici (volpe). L’infestazione non si trasmette da persona a persona.
Il periodo di incubazione è generalmente di circa 8-15 giorni, ma può variare da 5 a 45 giorni a seconda del numero di parassiti ingeriti.
Sintomi
Nell’uomo il quadro clinico varia dalle infezioni asintomatiche a casi particolarmente gravi, con alcuni decessi. La sintomatologia classica è caratterizzata da diarrea (che è presente in circa il 40% degli individui infetti), dolori muscolari, debolezza, sudorazione, edemi alle palpebre superiori, fotofobia e febbre.
Prevenzione
La prevenzione si base su misure igienico-sanitarie:
- consumere la carne ben cotta, in modo che le eventuali larve presenti vengano inattivate o distrutte dal calore (è sufficiente 1 minuto a 65°C). Il colore della carne deve virare dal rosa al bruno;
- la selvaggina e i maiali macellati a domicilio devono essere esaminati da un veterinario per determinare l’eventuale presenza delle larve del parassita nelle carn;
- se non è noto se la carne è stata sottoposta a esame trichinoscopico, è bene congelarla per almeno 1 mese a -15°C: un congelamento prolungato, infatti, uccide le larve
- nel caso si allevino maiali, impedire che mangino la carne cruda di animali, anche ratti, che potrebbero essere stati infestati dal parassita
- quando si macella la propria carne in casa, pulire bene gli strumenti;
- salatura, essiccamento, affumicamento e cottura nel forno a microonde della carne non assicurano l’uccisione del parassita.
La normativa europea
Regolamento di esecuzione (UE) 2015/1375 che definisce norme specifiche applicabili ai controlli ufficiali relativi alla presenza di Trichinella nelle carni.






